11 Novembre, 2016
Un lavoro scientifico pubblicato sul numero di novembre della rivista Nature Cell Biology da Fiorenza Fumagalli, Julia Noack, Timothy J. Bergmann et al. nel gruppo di Maurizio Molinari all’IRB identifica la proteina Sec62 come recettore autofagico che regola la distruzione di porzioni danneggiate o superflue del reticolo endoplasmatico (RE).
Il RE è un organello dedicato alla produzione di circa la metà delle proteine che circolano nel nostro corpo. Esso produce tutte le proteine che operano al di fuori dalle cellule, alla superficie delle cellule e negli organelli della via secretoria ed endocitica. Mantenere la funzionalità del RE persino in condizioni difficili quali vari tipi di stress fisiologici (differenziamento cellulare) o patologici (espressione di prodotti genici mutati caratteristici di molte malattie rare ereditarie o sporadiche, attacchi virali o batterici) è fondamentale per la vita, così come è importante riuscire a ristabilire le condizioni di funzionamento normale del RE nelle nostre cellule quando l’organismo è riuscito a debellare uno stress. In effetti, solo un RE perfettamente funzionante assicura la produzione delle proteine in giusta quantità e appropriata qualità.
Lo studio del gruppo Molinari rivela che il mantenimento e il ri-stabilimento della funzionalità del RE (per esempio nella fase di recupero da uno stress cellulare acuto) richiede l’attività della proteina Sec62 e una serie di eventi collettivamente definiti recovER-phagy dagli autori.
L’autofagia è un processo catabolico che regola la degradazione di materiale cellulare (per esempio proteine difettose o vecchie) per riciclarne i componenti (per esempio gli amminoacidi). Quest’anno, l’autofagia è balzata agli onori della cronaca visto che il premio Nobel 2016 per la Fisiologia e Medicina è stato attribuito al giapponese Yoshinori Ohsumi che ne ha caratterizzato i geni regolatori prima in lievito e poi nelle cellule di mammifero.
Molto recentemente si è scoperto che autofagia non si occupa solo della degradazione e riciclo di macromolecole. Si è anche riusciti a dimostrare che essa interviene anche nella rimozione dalle cellule di interi organelli come mitocondri e perossisomi. Quando danneggiati, questi organelli espongono recettori specifici che attirano componenti del sistema autofagico, scatenando il trasporto selettivo ai lisosomi dell’organello o della porzione di organello da distruggere. Il lavoro di Fumagalli et al. ha identificato il recettore che permette la distruzione di porzioni del RE quando le nostre cellule si stanno riprendendo da uno stress.
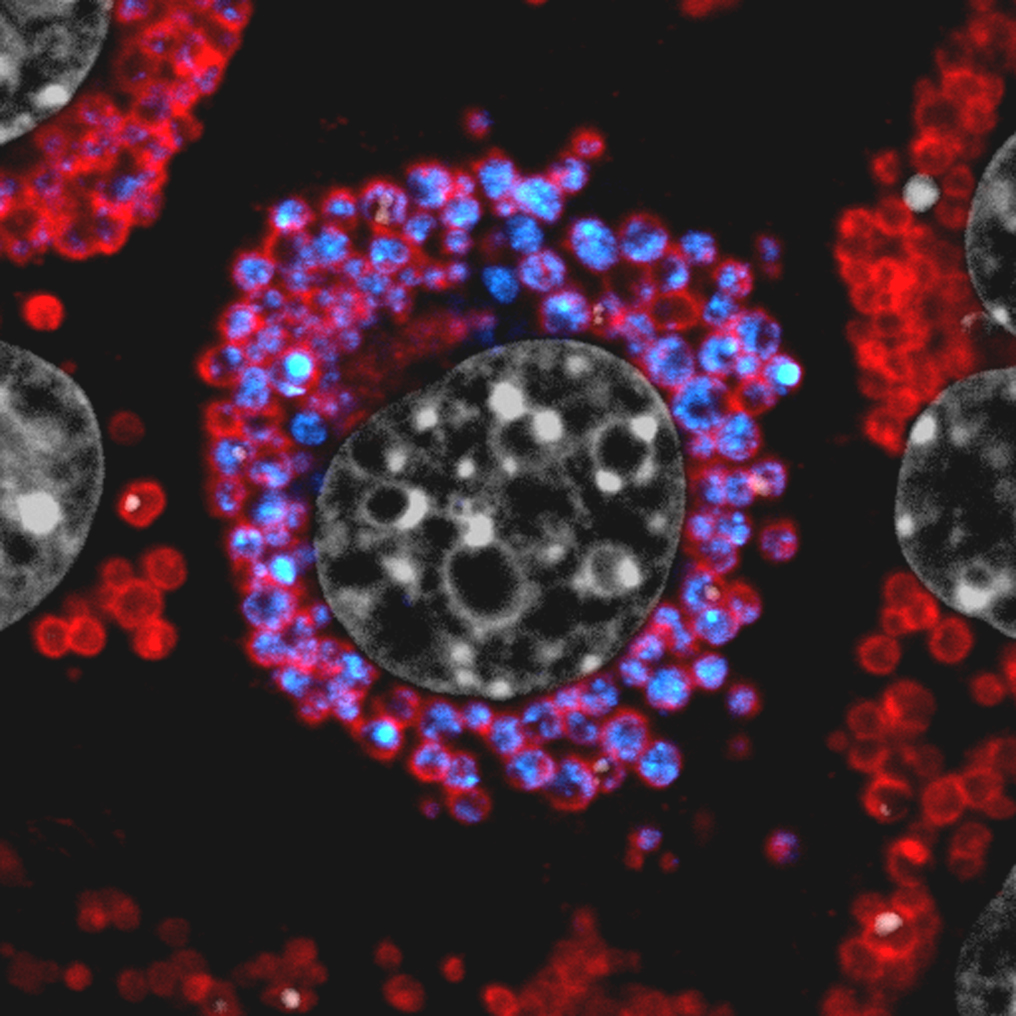
La cellula al centro produce livelli elevati di Sec62. Questo provoca il trasporto di frammenti del RE (blu) negli autolisosomi (la loro membrana esterna è colorata con un anticorpo anti-Lamp1 in rosso) dove il RE viene degradato.
L’importanza del lavoro è sottolineata da un articolo esplicativo (News and Views) scritto da Sebastian Schuck (Cell Network Cluster of Excellence and Zentrum für Molekulare Biologie der Universität Heidelberg (ZMBH)) e da vari altri commenti pubblicati da Faculty of 1000 e da altri giornali come Nature Reviews of Molecular and Cell Biology. In effetti, un coinvolgimento dell’autofagia nel recupero da stress era stato postulato oltre 40 anni fa, e domande tipo “come controllano le cellule le dimensioni e la funzionalità dei loro organelli?” sono rimaste senza risposte fino ad oggi. Le risposte a tali domande sono importanti per capire i meccanismi di adattamento delle cellule a stimoli patologici e fisiologici come la crescita, il differenziamento e le malattie. Gli articoli di commento sottolineano come “sfruttando i progressi tecnologici (nel lavoro sono state utilizzate tecnologie all’avanguardia nel campo della biologia cellulare come bioinformatica, peptide arrays, surface plasmon resonance, risonanza magnetica nucleare (NMR), modeling computazionale, microscopia confocale, correlativa e elettronica, un rivoluzionario sistema di editing genomico (CRISPR/Cas9), spettroscopia di massa) e scientifici, lo studio di Molinari e colleghi ha portato al livello molecolare la comprensione del controllo delle dimensioni degli organelli da parte delle nostre cellule e il concetto di ER-phagy (il meccanismo catabolico che lo regola)”. I commenti sottolineano anche il fatto che la proteina studiata, Sec62, è un candidato oncogene, e che quindi sarà interessante stabilire se le perturbazioni della funzionalità del RE e dei meccanismi di recovER-phagy contribuiscono ai fenotipi particolarmente gravi dei tumori caratterizzati da amplificazione del gene SEC62.




